Effetto della diluizione post-disgelo dello sperma di drone dializzato e crioconservato sulla qualità delle regine delle api da miele
- Davide Simeone
- 24 dic 2025
- Tempo di lettura: 11 min

Prefazione
La crioconservazione dello sperma del drone dell'ape (Apis melifera) rimane una sfida significativa. Nonostante decenni di ricerca, mantenere la vitalità e la funzionalità dello sperma dopo lo scongelamento continua a limitare l'uso pratico dello sperma congelato.
Questo studio ha indagato l'effetto della diluizione post-disgelo dello sperma di drone crioconservato con Bee Semen Solution (BSS) sulla vitalità dello sperma e sulle prestazioni riproduttive della regina. Le api regine sono state inseminate strumentalmente con sperma fresco o crioconservato, non diluito o diluito con BSS dopo lo scongelamento. È stato valutato l'impatto di questi trattamenti sul numero e sulla qualità degli spermatozoi nella spermateca e sul pattern di covata.
La crioconservazione ha influenzato notevolmente la qualità dello sperma e le prestazioni riproduttive delle regine inseminate, con conseguente minore vitalità dello sperma e ridotta fertilità rispetto allo sperma fresco. Tuttavia, la diluizione post-scongelamento dello sperma con BSS tendeva a migliorare i parametri dello sperma nella spermateca e nella fertilità regina. I risultati indicano che la manipolazione post-scongelamento dello sperma, compreso l'uso di diluenti appropriati, può svolgere un ruolo importante nel migliorare i risultati dell'inseminazione con lo sperma crioconservato con metodo di dialisi. Sottolineiamo anche che l'inseminazione multipla dovrebbe essere considerata come un metodo per migliorare il numero di spermatozoi nello spermateca e, di conseguenza, nella fertilità della regina.
Introduzione

La crioconservazione e lo stoccaggio del seme del drone delle api da miele (Apis mellifera) rimangono sfide chiave nell'inseminazione strumentale delle api, nell'allevamento e nella ricerca. Nonostante molti anni di tentativi per sviluppare protocolli efficaci (ad es. Melnichenko e Vavilov 1975, Harbo 1977, Kaftanoglu e Peng 1984, Hopkins e altri. 2012; Wegener et al. 2014a; Alçay et al. 2019), non esiste ancora un metodo ben consolidato ampiamente utilizzato che preservi la fertilità dello sperma dopo la conservazione a lungo termine (Cobey, 2016; Smilga-Spalvina et al., 2023). Le difficoltà associate alla crioconservazione dello sperma del drone includono il congelamento e lo stoccaggio dei campioni e la successiva inseminazione efficace delle api regine con materiale scongelato. Il congelamento e lo scongelamento aumentano chiaramente l'insorgenza di difetti morfologici con una percentuale più elevata di sperma con deformità della testa e code contorte (Yániz et al., 2024) e una minore motilità e vitalità dello sperma (Hopkins & Herr, 2010; Özkök & Selcuk, 2020).
Un certo numero di studi si concentra sul mezzo utilizzato per diluire lo sperma prima della crioconservazione e sul suo effetto sui parametri dello sperma (Harbo, 1979; Taylor et al., 2009; Hopkins & Herr, 2010; Wegener et al., 2012; Alçay et al., 2019; Alçay et al., 2022; Gulov & Laskin, 2021; Aktar et al., 2024; Nur et al., 2024; Mohammandi et al., 2025). Diversi studi hanno dimostrato la tossicità di alcuni dei crioprotettivi più comunemente usati su spermatozoi e/o api regine (Hopkins & Herr, 2010; Wegener & Bienefeld, 2012; Wegener et al., 2012). Una possibile soluzione per ridurre al minimo gli effetti tossici dei crioprotettivi sarebbe quella di diluire o rimuovere una quantità significativa del crioprotettivo tossico dopo la crioconservazione o lo scongelamento (Wegener, 2014a; Gül et al., 2017; Auth & Hopkins, 2021). Date queste limitazioni, una ricerca di diluenti alternativi che stabilizzano le membrane spermatiche dopo lo scongelamento senza causare danni eccessivi sembra ragionevole. Tuttavia, pochi studi hanno studiato l'effetto della diluizione dello sperma dopo la crioconservazione sulla sua qualità nelle spermateche e nella fertilità regina.
Wegener et al. (2014) hanno diluito lo sperma crioconservato con Bee Semen Solution (BSS), quindi lo hanno centrifugato per rimuovere il crioprotettivo e concentrare lo sperma. Questa procedura ha comportato una riduzione della motilità dello sperma nella spermateca e una diminuzione della fertilità della regina, con una percentuale della covata di operaie del 27%. Allo stesso modo, Gül et al. (2017) hanno lavato e centrifugato il campione di sperma con un diluente di sperma, nonché con soluzioni di glucosio e plasma di sperma fresco di drone. Tuttavia, non è stato ottenuto alcun miglioramento significativo nella fertilità della regina (percentuale di covata da operaie). In entrambi i casi, la centrifugazione dopo la diluizione può aver influenzato negativamente la funzionalità dello sperma e il successo dell'inseminazione (Cobey et al., 2013). Secondo Wegener et al. (2014), saltare la centrifugazione dello sperma dopo la crioconservazione a favore di una delicata diluizione di Bee Semen Solution (BSS) e la miscelazione manuale del campione ha aumentato la qualità dello sperma e i tassi di fertilità della regina.
Tuttavia, solo tre api regine sono state sottoposte a questa procedura e il rapporto di diluizione utilizzato (1 parte di sperma: 2 parti di BSS) differiva dal rapporto solitamente utilizzato nell'inseminazione delle api regine (1:1) (Skowronek et al., 1995; Gerula et al., 2016; Kahya & Gençer 2022). L'obiettivo dello studio era determinare come la diluizione dello sperma con BSS dopo la crioconservazione utilizzando il metodo di dialisi prima del congelamento influenzi la fertilità della regina, nonché il numero e la qualità degli spermatozoi nella spermateca.
Materiali e metodi (leggi l'articolo completo)
Risultati
La motilità dello sperma appena raccolto e scongelato ha raggiunto rispettivamente il 98% e il 62%, nei campioni testati. Lo sperma utilizzato per l'inseminazione (fresco, fresco diluito, crioconservato o crioconservato diluito) non ha influenzato in modo significativo la mortalità della regina (Tab. 1). La simulazione di Monte Carlo ha confermato che le differenze osservate tra i gruppi non erano significative (χ²=1,14, df=3, p=0,77). Le analisi non parametriche hanno rivelato effetti significativi del trattamento dello sperma su tutti i tratti valutati (test di Kruskal-Wallis, p<0,001 per tutti i tratti). Il modello di covata differiva significativamente tra i gruppi (H(3)=28,13, p<0,001).
Le regine inseminate con sperma crioconservato (gruppi 3 e 4) hanno prodotto meno covate di operaia rispetto a quelle inseminate con sperma fresco (gruppi 1 e 2) (Tab. 1). L'effetto della crioconservazione era forte (δ=0,94-1,00, grande effetto), mentre non è stata riscontrata alcuna differenza tra i gruppi di sperma fresco (p=1.000). Il confronto tra gruppi crioconservati (3 contro 4) ha indicato un effetto positivo da piccolo a medio della diluizione BSS (δ=-0,35), suggerendo un leggero anche se non significativo miglioramento biologico.
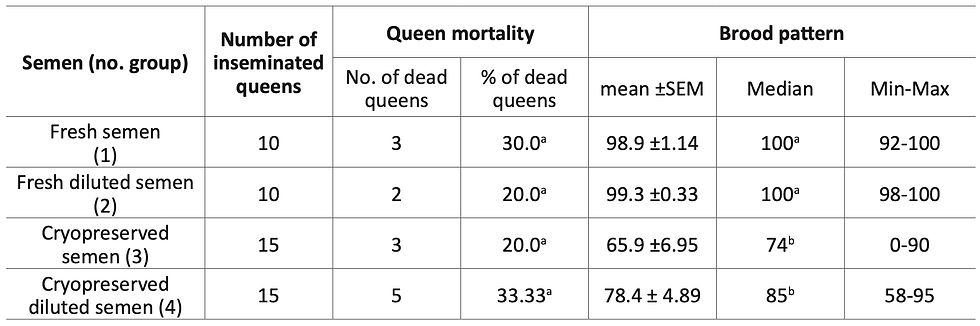
Il numero di spermatozoi nelle spermateche ha mostrato un effetto significativo del trattamento (H(3)=7,84, p=0,0005) (Tab. 2). Le regine inseminate con sperma crioconservato avevano un numero sostanzialmente inferiore di spermatozoi rispetto a quelle inseminate con sperma fresco (p<0,05, δ=0,72-1,00, grandi effetti). La diluizione del BSS tendeva ad aumentare il numero di spermatozoi nei campioni crioconservati (gruppo 3 vs gruppo 4), indicando un effetto positivo moderato (δ=-0,30), ma non significativo (p=1.000) (Tab. S1). Anche la motilità dello sperma è variata in modo significativo (H(3)=25,60, p<0,001) (Tab. 2). La crioconservazione ha influenzato una diminuzione della motilità, confermata da grandi dimensioni dell'effetto (δ=0,73-1,00). La diluizione post-scongelamento in BSS (gruppo 4) ha portato a una motilità moderatamente più alta rispetto allo sperma congelato non diluito (gruppo 3; δ=-0,52, ampio effetto), anche se la differenza non era significativa (p=0,26) (Tab. S1). Anche la vitalità dello sperma è stata significativamente influenzata dai trattamenti (H(3)=23,70, p<0,001) (Tab. 2).

Lo sperma crioconservato ha mostrato un forte declino della vitalità rispetto allo sperma fresco (δ=0,83-1,00, grandi effetti). Le regine inseminate con sperma post-scongelato diluito con BSS (gruppo 4) hanno mostrato una vitalità leggermente superiore rispetto a quelle che ricevono sperma non diluito (gruppo 3), ma la differenza era trascurabile (δ=0,03, p=1.000) (Tab. S1).
Discussione
I nostri risultati mostrano chiaramente che il processo di crioconservazione influisce sul numero di spermatozoi e sulla qualità dello sperma immagazzinato nelle spermateche. Questa scoperta è comunemente riportata nella letteratura scientifica (Harbo, 1983; Kaftanoglu & Peng, 1984; Hopkins et al., 2012; Wegener et al., 2012; Wegener et al., 2014a; Gül et al., 2017; Pallard et al., 2017; Gulov & Laskin, 2020, 2021; Yaniz et al., 2020; Nur et al., 2024; Egyptien et al., 2025; Mohammadi et al., 2025). Tuttavia, solo pochi studi hanno esaminato la fertilità delle regine inseminate con sperma crioconservato. Questi studi differiscono in termini di metodo di congelamento e composizione diluente utilizzata, sia prima che, in alcuni casi, dopo il congelamento. Tuttavia, la vera misura dell'efficacia e dell'efficienza dello sperma del drone crioconservato è se la regina inseminata produce un numero adeguato di lavoratori per sostenere la crescita della colonia di api (Bryła & Trzcińska, 2024) o almeno abbastanza uova fecondate per allevare nuove regine, preservando così le linee genetiche e sostenendo l'allevamento selettivo (Wegener et al., 2012).
La nostra ricerca e gli studi precedenti hanno costantemente dimostrato che le regine inseminate con sperma crioconservato sono in grado di produrre uova fecondate, anche se i risultati complessivi della fertilità sono stati variabili. Primi esperimenti di Harbo (1983) e Kaftanoglu E Peng (1984) hanno dimostrato un'oviposizione di successo dopo singole inseminazioni (rispettivamente 3,3 µl e volumi non specificati), ma le proporzioni di covata operaia (rispettivamente 8-22% e 47%) e la conta degli spermatozoi (0,1-0,2 milioni) sono rimaste basse. Gli sforzi per ottimizzare i diluenti hanno prodotto risultati contrastanti. Wegener et al. (2012) hanno scoperto che l'uso di dimetilsolfossido (DMSO) durante la crioconservazione ha ridotto il numero di spermatozoi (0,7-1,3 milioni contro 2,4-3,6 milioni per lo sperma fresco), mentre l'aggiunta di crioprotettivo attraverso la dialisi dello sperma ha migliorato la percentuale di covata dei lavoratori al 49-79% (Wegener et al., 2014a). Una delicata diluizione post-scongelamento invece della centrifugazione ha ulteriormente migliorato la fertilità, producendo fino al 65,8% della covata dei lavoratori e 1,8 milioni di spermatozoi nella spermateca (Wegener et al., 2014a).

Allo stesso modo, i buoni risultati sono stati ottenuti da Hopkins et al. (2012), che hanno dimostrato che le regine inseminate con 5 µL di sperma crioconservato potrebbero produrre prole fertile attraverso le generazioni, con un successo di fecondazione che raggiunge il 95-100% (in media il 50% iniziale e il 46% nella prima generazione). Studi successivi hanno cercato di migliorare la vitalità dello sperma post-disgelo e la fertilità della regina attraverso la modifica dei protocolli di congelamento e inseminazione. Gül et al. (2017) hanno riferito che le regine inseminate una volta con 5 µl di sperma post-scongelato lavato nel plasma dello sperma del drone hanno raggiunto percentuali di covata di operaie paragonabili ai controlli congelati (rispettivamente 48% e 47%) e il numero di spermatozoi in spermateche (0,81-1,6 milioni, rispettivamente) senza un miglioramento significativo. Tali diluenti alternativi prima del congelamento come soluzioni a base di miele, hanno prodotto risultati più promettenti.
Gulov e Laskin (2020, 2021) hanno riferito che le regine che hanno inseminato una volta con 8-12 µL di sperma crioconservato hanno deposto uova fecondate tra il 17 e il 99% (media 61%) e una media di 1,98 milioni di spermatozoi nella spermateca. A sua volta, Nur et al. (2024) hanno raggiunto l'oviposizione dopo singole inseminazioni (8-10 µL) utilizzando diluenti privi di crioprotettivi, anche se non sono stati forniti dati sulla covata e sullo sperma. L'eccessiva diluizione, come dimostrato da Pallard et al. (2017), ha ridotto la conta degli spermatozoi a 0,14-0,15 milioni indipendentemente dalla centrifugazione.
Inoltre, utilizzando una semplice procedura di congelamento senza antibiotici, Egyptien et al. (2025) hanno ottenuto uova fecondate da una piccola percentuale di regine inseminate una volta con 5 µL di sperma crioconservato, confermando la fattibilità ma l'efficienza limitata. Allo stesso tempo, il presente studio ha ottenuto alte percentuali di uova fecondate, sia nel gruppo con sperma crioconservato non diluito (fino al 90%; media 66%) che diluito (fino al 95%; media 78%), e anche il numero di spermatozoi nella spermateca era superiore rispetto ai risultati precedentemente riportati (1,86 e 2,04, rispettivamente).
Collettivamente, questi studi indicano che mentre lo sperma crioconservato può sostenere la fecondazione e la produzione di lavoratori, i risultati rimangono fortemente dipendenti dal volume di inseminazione, dalla gestione dello sperma (diluizione, centrifugazione) e dalla scelta di crioprotettivo o diluente. Nello studio presentato, le regine sono state inseminate due volte, il che potrebbe aver contribuito alla differenza nel riempimento della spermateca rispetto agli studi precedenti. Secondo Woyke (1960), Mackensen (1964) e Bieńkowska et al. (2011), dividere una singola dose di sperma in due inseminazioni aumenta il numero di spermatozoi nella spermateca rispetto a una singola inseminazione.
Gli studi condotti sullo sperma scongelato hanno anche dimostrato che l'inseminazione di una regina di api da miele due volte con piccole quantità di sperma diluito si traduce in un numero significativamente maggiore di sperma che entra nella spermateca rispetto al caso di singole inseminazioni con l'uso dello stesso volume totale (Bolten & Harbo, 1982). La seconda inseminazione fornisce dal 68% al 77% in più di spermatozoi alla spermateca rispetto alla prima (Bolten & Harbo, 1982). Tuttavia, Gąbka (2021) non ha trovato alcuna differenza nell'insorgenza della deposizione delle uova tra le regine inseminate con diverse dosi di sperma. Inoltre, le inseminazioni multiple possono aumentare il rischio di contaminazione dello sperma e infezione della regina (Gąbka, 2021; Smilga-Spalvina et al., 2023).

Tuttavia, le inseminazioni multiple sembrano ragionevoli per aumentare il numero di spermatozoi che
raggiungono la spermateca, in particolare quando lo sperma crioconservato viene utilizzato per l'inseminazione in cui il processo di congelamento stesso influisce sulla vitalità e motilità dello sperma, influenzando di conseguenza le prestazioni della regina (Wegener et al., 2012; Yániz et al., 2024). La diluizione dello sperma nel mezzo appropriato potrebbe anche aver influenzato i nostri risultati, anche se l'uso della diluizione dello sperma fresco non ha migliorato significativamente i parametri studiati. Precedenti esperimenti con sperma diluito fresco hanno dimostrato che la diluizione non ha un grande effetto sul successo delle inseminazioni (Mackensen, 1969; Skowronek et al., 1995; Lodesani et al., 2003; Gerula et al., 2016; Gąbka & Cobey, 2018; Kahya & Gençer, 2022). I risultati di questi studi, indipendentemente dal diluente utilizzato o dal rapporto sperma-diluente, non hanno rivelato disparità significative nel numero di spermatozoi immagazzinati nella spermateca delle regine inseminata con sperma non diluito e diluito. Allo stesso modo, la diluizione dello sperma crioconservato non ha portato a differenze significative rispetto allo sperma crioconservato non diluito. Tuttavia, l'effetto della diluizione può essere maggiore quando segue la dialisi dello sperma contro una soluzione crioprotettiva ipertonica, come nel presente esperimento. La dialisi ritira chiaramente l'acqua dallo sperma e la diluizione post-scongelamento potrebbe potenzialmente ristabilire un'osmolarità e una viscosità naturali. Questo può spiegare perché l'analisi delle mediane, delle medie e degli effetti delle dimensioni (delta di Cliff) ha rivelato una chiara tendenza verso valori più alti nello sperma congelato diluito. Ciò era particolarmente evidente in termini di motilità degli spermatozoi, nonché di numero di spermatozoi e modello di covata.
Uno degli ingredienti del diluente utilizzato - BSS (Wegener et al., 2014) è il trealosio, che si trova nel fluido seminale del drone (Blum et al., 1962). Molte di queste molecole come proteine, aminoacidi e zuccheri presenti nel fluido seminale dei droni sono note per aiutare la vitalità dello sperma dopo lo stoccaggio (den Boer et al., 2009). Secondo Nur et al. (2020), l'aggiunta di 0,1 o 0,05 M di trealosio al mezzo di congelamento contenente il 12% di DMSO ha incrementato la motilità cellulare post-scongelamento e l'integrità della membrana plasmatica degli spermatozoi. Inoltre, l'uso di trealosio senza DMSO consente di mantenere una percentuale significativamente più alta di motilità degli sperma e parametri cinetici dopo la crioconservazione rispetto a DMSO e glicerolo (Tsvetkov et al., 2024). L'uso di BSS con trealosio potrebbe mitigare in una certa misura l'impatto negativo del congelamento sulla motilità dello sperma, il che potrebbe migliorare la capacità delle regine di deporre gli ovuli.
Nelle api da miele, perdite significative di spermatozoi si verificano naturalmente in termini di numero e vitalità nella fase di trasporto agli ovidotti e alla spermateca. In condizioni naturali, solo il 3-5% dello sperma raggiunge la spermateca (Yaniz et al., 2020), quindi qualsiasi ulteriore riduzione dello sperma mobile derivante dalla crioconservazione potrebbe avere un impatto significativo sulla fertilità della regina. Secondo Paillard et al. (2017), le regine sono a maggior rischio di non riuscire a deporre gli ovuli fecondati quando meno di 0,5 milioni di spermatozoi raggiungono la spermateca. In questo contesto, la diluizione dello sperma può essere considerata un mezzo per migliorare la dispersione dello sperma.
Vale anche la pena notare la riduzione della viscosità dello sperma attraverso la diluizione (Tofilski, 2014; Bratu & Pătruică, 2021). Lo sperma è molto denso, tende a raggrupparsi (Cobey et al., 2013) in particolare quando viene raccolto da droni più vecchi (Czekońska et al., 2013), ed è più difficile da assorbire nell'ago, specialmente quando viene utilizzato un diametro della punta più piccolo (Bieńkowska & Panasiuk, 2006). La diluizione dello sperma potrebbe potenzialmente facilitare sia la somministrazione tecnica del campione durante l'inseminazione che la successiva migrazione degli spermatozoi nel tratto riproduttivo della regina.
Sono necessari ulteriori studi sulla composizione dei diluenti e dei protocolli di inseminazione per ottimizzare la fertilità della regina e rendere la crioconservazione dello sperma uno strumento praticabile per l'allevamento delle api da miele e la conservazione genetica.
Published: December, 2025
Autori:
Małgorzata Bieńkowska, Mikołaj Borański, Beata Panasiuk, Dariusz Gerula - The National Institute of Horticultural Research, Poland
Jakob Wegener - GrüBie Ashiralieva&Wegener Gbr, Germany
traduzione a cura di Davide Simeone



Commenti